Uitstrijkje/fr: verschil tussen versies
Uit wikilab
(Nieuwe pagina aangemaakt met '==Accessoires== right *2 lames porte objet à bord mat *Crayon *Pipette Pasteur en verre ou seringue (sans aiguille) *Etui de prot...') |
(Nieuwe pagina aangemaakt met '==Procédure== #Déposez une lame porte objet sur la table #Marquez la lame au crayon du côté du bord mat. #Aspirez l’échantillon avec une pipette Pasteur en v...') |
||
| Regel 6: | Regel 6: | ||
*Etui de protection pour transport | *Etui de protection pour transport | ||
| − | == | + | ==Procédure== |
| − | # | + | #Déposez une lame porte objet sur la table |
| − | # | + | #Marquez la lame au crayon du côté du bord mat. |
| − | # | + | #Aspirez l’échantillon avec une pipette Pasteur en verre capillaire. |
| − | # | + | #Déposez une petite goutte (diamètre 2 mm) juste à côté du bord mat. |
| − | # | + | #Mettez la 2ième lame (l’étaleur) en oblique (sous 30-45°) au milieu de la lame. |
| − | # | + | #Touchez la goutte en repoussant la lame étaleuse (donc en tirant la goutte). |
| − | # | + | #La goutte se repartira le long du bord de l’étaleur. #N’attendez pas trop longtemps afin d’éviter l’accumulation de globules rouges. |
| − | # | + | #Soulevez progressivement l’étaleur, toujours en le tenant sous 30-45°. Le frottis doit s’arrêter à environ 1-2 cm de l’autre extrémité de la lame. |
{| | {| | ||
Versie van 16 dec 2014 om 01:43
Accessoires
- 2 lames porte objet à bord mat
- Crayon
- Pipette Pasteur en verre ou seringue (sans aiguille)
- Etui de protection pour transport
Procédure
- Déposez une lame porte objet sur la table
- Marquez la lame au crayon du côté du bord mat.
- Aspirez l’échantillon avec une pipette Pasteur en verre capillaire.
- Déposez une petite goutte (diamètre 2 mm) juste à côté du bord mat.
- Mettez la 2ième lame (l’étaleur) en oblique (sous 30-45°) au milieu de la lame.
- Touchez la goutte en repoussant la lame étaleuse (donc en tirant la goutte).
- La goutte se repartira le long du bord de l’étaleur. #N’attendez pas trop longtemps afin d’éviter l’accumulation de globules rouges.
- Soulevez progressivement l’étaleur, toujours en le tenant sous 30-45°. Le frottis doit s’arrêter à environ 1-2 cm de l’autre extrémité de la lame.
| FOUT | JUIST |
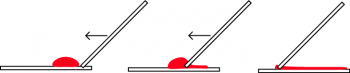
|
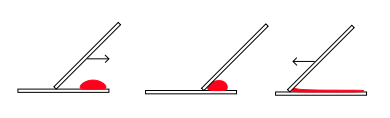
|
Deze korte video-opname laat het allemaal nog eens duidelijk zien.
Problemen
- Te veel materiaal. Dit resulteert in te dikke uitstrijkjes die microscopisch niet of moeillijk beoordeeld kunnen worden. Eigenlijk moet al het materiaal uitgestreken zijn als men het einde van het draagglaasje bereikt. Aan de bovenkant mag er dus praktisch niets meer te zien zijn.
- Te weinig materiaal. Dit resulteert in dunne uitstrijkjes die een verkeerd beeld geven van de cellulariteit.
- Te vast materiaal (bvb verkaasde etter of geaspireerd vast weefsel) strijkt moeilijk uit. Tijdens microscopie ziet men diep donkere velden celmateriaal die men met geluk enkel langs de rand kan beoordelen. Men kan dit voorkomen door het staal met een kleine hoeveel fysiologisch water eerst te suspenderen en van deze suspensie het uitstrijkje te maken.
- Vettig materiaal strijkt wel uit maar droogt slecht aan de lucht. Dit is een belangrijk gegeven op zich en vaak indicatief voor een lipoma. Noteer dit op het aanvraagformulier.
- Stuk strijken door over de staaldruppel te gaan en deze voor zich uit te duwen ipv hem mee te trekken, of door meerdere keren te strijken. Microscopisch krijgt men lange strepen uiteengereten kernmateriaal te zien (zie foto). Van intacte cellen is soms geen sprake meer. Hetzelfde effect kan men krijgen wanneer men geaspireerd materiaal opnieuw langs de naald eruit spuit. Daarom altijd de naald van de spuit verwijderen!